1)Թվարկե՛ք ու պարզաբանե՛ք էլեկտրոլիտային դիսոցման ժամանակակից տեսության չորս հիմնադրույթը:
Հաղորդիչներ են այն նյութերը, որոնցում առկա են ազատ լիցքակիր մասնիկներ: Մետաղներում, որոնք համարվում են առաջին կարգի հաղորդիչներ, առկա են ազատ էլեկտրոններ, և էլեկտրական հոսանքը նրանցում էլեկտրոնների ուղղորդված հոսքն է.
Որոշ նյութերի ջրային լուծույթներում (էլեկտրոլիտներում), որոնք համարվում են երկրորդ կարգի հաղորդիչներ, էլեկտրական հոսանքը իոնների հոսք է, այսինքն՝ էլեկտրոլիտներին բնորոշ է իոնային հաղորդականությունը.
2)Ինչո՞վ են տարբերվում իոններն ատոմներից։
Իոնների հատկությունները և կառուցվածքը
Իոններն ատոմներից տարբերվում են իրենց էլեկտրոնային կառուցվածքով, հետևաբար, և հատկություններով:
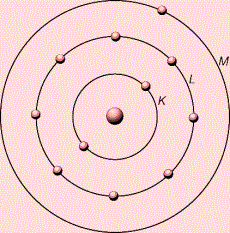
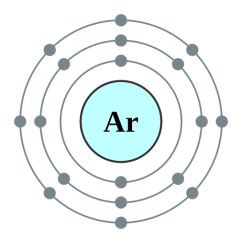
Համեմատենք նատրիում և քլոր տարրերի ատոմների՝ 𝑁𝑎0,Cl0 և համապատասխան իոնների՝ Na+,Cl− որոշ հատկությունները.
* էլեկտրոնային կառուցվածք.
Na-ի ատոմի արտաքին էլեկտրոնային շերտում (M) կա մեկ էլեկտրոն
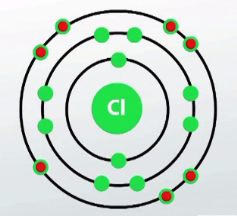
Cl-ի ատոմի արտաքին էլեկտրոնային շերտում (M) կա 7 էլեկտրոն:
Իսկ համապատասխան իոններն արտաքին էլեկտրոնային շերտում ունեն ութական էլեկտրոն և նման են իներտ գազերի էլեկտրոնային կառուցվածքին.
Na+ իոնն ունի իներտ գազ Ne-ի էլեկտրոնային կառուցվածքը,
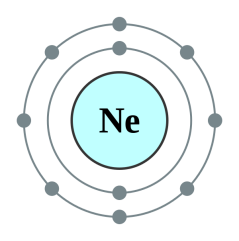
Cl− իոնն ունի իներտ գազ Ar-ի էլեկտրոնային կառուցվածքը.
* ագրեգատային վիճակը

3. Ինչո՞ւ է էլեկտրոլիտային դիսոցման գործընթացը դարձելի։
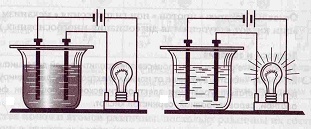
Էլեկտրոլիտներ են այն նյութերը, որոնց ջրային լուծույթները էլեկտրական հոսանք են հաղորդում, իսկ ոչ էլեկտրոլիտներ են այն նյութերը, որոնց ջրային լուծույթները էլեկտրական հոսանք չեն հաղորդում:
Նյութի պատկանելիությունը էլեկտրոլիտներին կարելի է ստուգել էլեկտրահաղորդականություն ստուգող սարքի միջոցով: Ինչպես երևում է նկարում, ոչ էլեկտրոլիտները հոսանք չեն անցկացնում, ինչի պատճառով լամպը չի վառվում, իսկ էլեկտրոլիտներում՝ վառվում է:
Աղերը, թթուները, հիմքերը էլեկտրոլիտ են, իսկ օրգանական միացությունների մեծ մասը (գլյուկոզ, սպիրտ, շաքար, ացետոն և այլն), ինչպես նաև մի շարք անօգանական նյութեր (թթվածին՝ O2, ազոտ՝ N2, ազոտի(I) օքսիդ՝ N2O և այլն) էլեկտրոլիտ չեն:
Հալված վիճակում հոսանքի հաղորդիչներ են նաև իոնական կապով բազմաթիվ միացություններ. աղեր, հիմքեր և որոշ օքսիդներ:
Գազային վիճակում գտնվող որոշ նյութերի (քլորաջրածին, բրոմաջրածին, ծծմբաջրածին և այլն) ջրային լուծույթները նույնպես էլեկտրական հոսանքի հաղորդիչներ են:
Իսկ ինչպե՞ս են ստեղծվում լիցքակիր մասնիկները՝ իոնները էլեկտրոլիտների լուծույթներում և հալույթներում: Առաջինն այս հարցին պատասխանել է շվեդ գիտնական Սվանտե Արենիուսը,
4)Արդյոք կարո՞ղ են էլեկտրոլիտը ջրում լուծելիս միայն կատիոններ կամ միայն անիոններ առաջանալ: Ինչո՞ւ: